 Dalam setiap persamaan reaksi yang sudah setara,
perbandingan koefisien reaksi menyatakan perbandingan jumlah mol zat. Dari
suatu persamaan reaksi kimia dapat diketahui hubungan kualitatif dan
kuantitatif dengan pereaksi dan hasil reaksi zat yang terlibat. Untuk
mempermudah dalam menyelesaikan soal-soal hitungan kimia, digunakan empat
langkah penyelesaian berikut.
Dalam setiap persamaan reaksi yang sudah setara,
perbandingan koefisien reaksi menyatakan perbandingan jumlah mol zat. Dari
suatu persamaan reaksi kimia dapat diketahui hubungan kualitatif dan
kuantitatif dengan pereaksi dan hasil reaksi zat yang terlibat. Untuk
mempermudah dalam menyelesaikan soal-soal hitungan kimia, digunakan empat
langkah penyelesaian berikut.a. Menuliskan persamaan reaksi dan menyetarakan koefisiennya
b. Mengubah satuan zat yang diketahui dalam soal menjadi mol,
c. Mencari mol zat yang ditanyakan. Caranya dengan membandingkan koefisien zat yang ditanya (dicari) dengan koefisien zat yang diketahui dan dikali mol zat yang diketahui,
d. Mengubah satuan mol menjadi satuan lain yang diinginkan (ditanyakan)
KONVERSI PERHITUNGAN KIMIA DALAM BERBAGAI SATUAN
Contoh:
Sebanyak
5,85 gram garam dapur (NaCl) habis bereaksi dengan larutan asam sulfat (H2SO4)
membentuk larutan natrium sulfat (Na2SO4) dan asam
klorida (HCl). Reaksinya sebagai berikut :
NaCl (s) + H2SO4(aq) → Na2SO4(aq) + HCl(aq) (belum setara)
Berapa
gram natrium sulfat yang terbentuk?
Penyelesaian:
Langkah 1 : Menuliskan
persamaan reaksi lengkap dengan koefisien
2NaCl (s) + H2SO4(aq) → Na2SO4(aq) + 2HCl(aq)
Langkah 2 : Mengubah satuan yang diketahui ke dalam
satuan mol
Langkah 3 : Menentukan mol zat yang ditanyakan
berdasarkan perbandingan koefisien
Langkah 4 : Mengubah satuan mol menjadi satuan yang
ditanyakan
Mr
Na2SO4 = 142  Mm = 142 g/mol
Mm = 142 g/mol
Massa
Na2SO4 = n x Mm
0,05
mol Na2SO4 x 142 g/mol = 7,1 gram
Jadi, massa
Na2SO4 yang terbentuk adalah 7,1 gram
Bila dua zat direaksikan akan didapatkan dua kemungkinan.
Kemungkinan pertama; kedua pereaksi tepat habis bereaksi dan kemungkinan kedua;
salah satu pereaksi habis sedangkan pereaksi yang lain bersisa. Pereaksi yang
habis akan membatasi hasil reaksi yang didapat. Pereaksi yang membatasi hasil
ini disebut dengan pereaksi pembatas.
Contoh Soal:
Perhatikan
persamaan reaksi berikut.
N2(g)
+ 3 H2(g) → 2 NH3(s)
Jika
1 mol N2 direaksikan dengan 2 mol H2, tentukan:
a.
pereaksi pembatas
b.
jumlah mol yang tersisa,
c.
jumlah mol NH3.
Diketahui :
n N2 = 1 mol
n H2
= 2 mol
Ditanyakan
: a. Pereaksi pembatas
b. n yang tersisa
c. n NH3
Penyelesaian
a. Pereaksi pembatas
Pereaksi pembatas dapat dilihat dari
perbandingan mol dengan koefisien.
Zat dengan perbandingan terkecil akan menjadi pereaksi pembatas. Jadi
zat yang bertindak sebagai pereaksi pembatas adalah H2
b. Jumlah mol yang tersisa
Jumlah mol yang tersisa dapat
ditentukan dengan berpatokan pada pereaksi pembatas
Jadi jumlah mol N2 yang tersisa adalah 0,33
mol
c. Jumlah mol NH3 yang terbentuk
Jumlah mol yang terbentuk dapat ditentukan
dengan berpatokan pada pereaksi pembatas
Dari data
tersebut terlihat bahwa mol H2 habis bereaksi (pereaksi pembatas),
sedangkan N2 tersisa sebanyak 0,33 mol. Selain itu juga terlihat
jumlah mol NH3 yang terbentuk
lebih lengkap untuk materi tersebut di atas, kalian bisa lihat pada linnk berikut!
Bahan Ajar Stoikiometri Reaksi Kimia
LKS Stoikiometri Reaksi Kimia
Latihan Soal I
Latihan soal II
---------* selamat berlatih * ---------


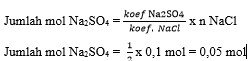

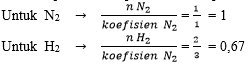


No comments:
Post a Comment