Hai sahabat chemistrylovers...Pernahkah kalian melarutkan sejumlah garam dapur dalam larutan air? Ketika kalian melarutkan satu sendok garam dapur ke dalam satu gelas air, maka garam tersebut akan larut. Namun, bagaimana jika garam dapur ditambahkan lebih banyak lagi? Jika jumlah garam yang dilarutkan terus ditambah, maka garam yang ditambakan tidak dapat lagi larut. Mengapa hal tersebut dapat terjadi? Meskipun demikian, garam dapur tetap digolongkan ke dalam garam yang mudah larut dalam air. Jika yang kita larutkan adalah garam yang sukar larut dalam air, maka hanya sedikit sekali garam yang dapat terlarut
Banyak sedikitnya jumlah zat yang dapat larut dalam air tergantung nilai kelarutannya. Kelarutan dilambangkan dengan "s" (solubility) merupakan jumlah maksimal zat terlarut (dalam gram) yang dapat larut dalam sejumlah tertentu pelarut pada suhu tertentu. Sedangkan kelarutan molar adalah jumlah mol maksimal zat terlarut yang dapat larut dalam sejumlah tertentu pelarut pada suhu tertentu.
Jika kita melarutkan zat tertentu, kemudian jumlahnya terus kita tambah, maka akan tercapai suatu kondisi tertentu yang pada saat itu jumlah zat yeng telah larut mencapi batas maksimalnya (kelarutan). Kondisi seperti ini yang disebut larutan telah jenuh. Pada larutan yang telah jenuh terjadi kesetimbangan antara proses pelarutan dan pembentukan kristal (endapan). Oleh kareana itu, jika kita tambahkan lagi sejumlah zat terlarut, maka akan terjadi pergeseran kesetimbangan ke arah pembentukan endapan, sehingga zat yang kita tambahkan seolah-olah tidak larut.
Kelarutan dari senyawa ion yang mudah larut dalam air biasanya dinyatakan dalam gram per 100 mL. sedangkan kelarutan senyawa ion yang sukar larut dalam air dinyatakan dalam mol/L.
Perhatikan contoh soal berikut!
AgCl merupakan salah satu contoh garam yang sukar larut dalam air. Pada pelarutan AgCl, diketahui bahwa jumlah maksimal zat tersebut yang dapat larut dalam 100 mL air adalah 2,34 mg AgCl. Nyatakan kelarutan molar dari AgCl tersebut! (Ar Ag = 108, Cl = 35,5)
Jawab:
TETAPAN HASIL KALI KELARUTAN (Ksp)
Jika kita melarutkan padatan garam yang sukar larut misalnya AgCl ke dalam air, maka sangat sedikit yang dapat larut dan terjedi kesetimbangan pada saat larutan telah jenuh. Berikut ini reaksi kesetimbangan yang terjadi:
Pada saat kesetimbangan terbentuk, laju reaksi pelarutan sama dengan jalu reaksi pengkristalan.
Gambar : kesetimbangan antara larutan AgCl dengan Kristal AgCl
Tetapan kesetimbangan untuk reaksi kesetimbangan AgCl di atas dapat dirumuskan sebagai berikut.
tetapan kesetimbangan inilah disebut dengan TETAPAN HASIL KALI KELARUTAN (Ksp). Jadi rumus di atas dapat ditulis sebagai berikut.
Catt: Nilai Ksp tergantung pada suhu
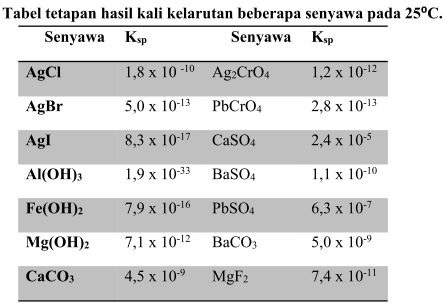
Tetapan hasil kali kelarutan hanya berlaku pada larutan jenuh, dan Ksp tidak mempunyai satuan. Berikut ini nilai tetapan hasil kali kelarutan beberapa senyawa pada 25⁰C.
Untuk memperdalam pemahaman anda tentang perumusan Ksp, perhatikan kesetimbangan garam Ag2CrO4.
Dalam larutan, padatan Ag2CrO4 mengalami kesetimbangan sesuai persamaan berikut:
Tetapan hasil kali kelarutannya (Ksp)
Contoh soal: tentukan hasil kali kelarutan (Ksp) Fe(OH)2 jika kelarutannya adalah 2,5 x 10-6
penyelesaian
1. Buat reaksi kesetimbangan Fe(OH)2
2. Tentukan konentrasi ion - ion (kation dan anion)
3. Tentukan Ksp
Jadi Ksp-nya adalah 6,25 x 10-17
HUBUNGAN Ksp DENGAN KELARUTAN (s)
Seperti sudah kita bahas di atas, Hasil Kali Kelarutan (Ksp) sangat tergantung pada konsentrasi kation dan anion hasil dari pelarutan garam tersebut. Jenis-jenis garam sangat beragam, berikut hubungan antara Ksp dengan kelarutan (s).
Tabel. Hubungan Tetapan Hasil Kali Kelarutan (Ksp) dengan Kelarutan (s)
Contoh soal.
Suatu garam magnesium karbonat dilarutkan dalam air 1 L. Jika Ksp MgCO3 = 3,5 X 10-8 , berapakah kelarutan (s) dari magnesium karbonat tersebut?
Jawabannya:
Kelarutan MgCO3 = s
Ksp MgCO3 = 3,5 X 10-8
reaksi kesetimbangan
jadi:
Nah demikianlah materi mengenai kelarutan dan hasil kali kelarutan paeda halaman ini. untuk lebih memahami materi tersebut, cobalah kalian berlatih menyelesaikan pertanyaan-pertanyaan berikut!
selamat berlatih--salam chembucket--
















No comments:
Post a Comment